
Il software è diventato “prodotto” per la prima volta nel 2021 con il regolamento UE 2017/745 per i dispositivi medici o MDR. Una sfida per PMI del settore e per il mercato assicurativo. Ce ne occupiamo in tre puntate a partire da uno sguardo al mercato dei MD in generale, dei Dispositivi Medici Software in particolare e da un caso studio. Parte 1.
MDR o Medical Device Regulation in sintesi
“Pubblicato nella Gazzetta ufficiale dell’Unione Europea nell’aprile 2017, l’MDR è stato sviluppato per riflettere i significativi progressi nelle tecnologie dei dispositivi medici che si sono verificati dall’attuazione del quadro iniziale europeo negli anni ’90 e per armonizzare il processo di revisione e approvazione normativa in tutti gli Stati membri dell’UE. I requisiti dell’MDR sono diventati applicabili a tutti i dispositivi medici venduti nell’UE a partire dal 26 maggio 2021.” (Tuvsud.com)
M. D., per vent’anni responsabile tecnica di CONSOBIOMED nel distretto medicale di Mirandola (MO), ci ha dato la seguente sintesi e il suo punto di vista sull’impatto dell’MDR a fine 2022:
MDR e complessità per le PMI
“Il mondo dei dispositivi medici è molto vasto e variegato. Il fatto che i software possano essere dei dispositivi medici non è una novità dei regolamenti denominati MDR e IVDR (ndr: dispositivi in vitro). Il problema attuale delle imprese, soprattutto delle PMI, è certificare in conformità all’MDR i dispositivi che erano già sul mercato in conformità alla precedente legge. Questo comporta un maggior numero di test, prove e altre evidenze da fornire riguardo ai rischi del dispositivo rispetto ai benefici derivanti dal loro utilizzo; ovvero un aumento notevole dei costi, inclusi quelli necessari per la certificazione CE dei dispositivi. Temo che questo stia seriamente andando a discapito dell’innovazione.
Il regolamento ora si rivolge a tutti gli operatori economici, non solo ai fabbricanti. Di conseguenza importatori e distributori di dispositivi medici, prima trascurati dalla direttiva, sono chiamati a rispettare dei precisi obblighi di legge. Va ricordato che sono state previste anche sanzioni con i decreti legislativi numero 137 e 138 del 5 agosto 2022. Tutto questo per dire che la situazione è complessa.”
Nel frattempo e specificatamente da febbraio 2023, la cosiddetta fase transitoria di passaggio dallo MDD al MDR e quindi la validità delle certificazioni CE precedenti allo MDR, è prorogata – per classe di rischio –sino al 2027 o 2028 (approfondisci).
Chi interessa questo Regolamento? Che dimensione ha questo “mondo variegato” dei Dispositivi Medici?
Il mercato dei dispositivi medici software
La UE è uno dei maggiori mercati mondiali per i dispositivi medici con circa 140 miliardi di euro di vendite nel 2022. Essa rappresenta quasi il 30% del mercato globale, seconda solo agli Stati Uniti (41%). Si prevede che le vendite totali di dispositivi medici nell’UE supereranno i 170 miliardi di euro entro il 2027, grazie anche a progressi tecnologici in ambiti come l’intelligenza artificiale (AI) e il monitoraggio da remoto. L’UE è dunque un mercato importante per tutti i fabbricanti di dispositivi medici, dalle grandi aziende alle start-up innovative.
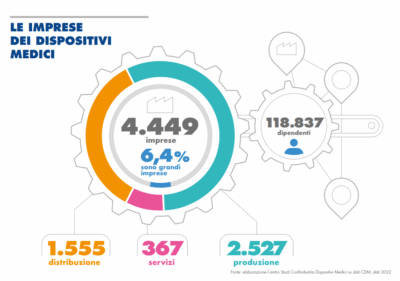 In Italia Confindustria MD dichiara in un report aggiornato al 1.1.2024: “Un giro d’affari di 18,3 miliardi di euro (+10%) tra export e mercato interno e 4.641 aziende (+20%), che occupano 117.607 dipendenti. Si tratta di un tessuto industriale molto eterogeneo, altamente innovativo e specializzato, dove le piccole aziende convivono con i grandi gruppi. Sono 2.749 le imprese di produzione che, insieme alle 1.531 di distribuzione e alle 361 di servizi producono o distribuiscono i dispositivi medici nel nostro Paese. Il tessuto imprenditoriale del settore è caratterizzato da una forte prevalenza di PMI (quasi il 94% del totale)”.
In Italia Confindustria MD dichiara in un report aggiornato al 1.1.2024: “Un giro d’affari di 18,3 miliardi di euro (+10%) tra export e mercato interno e 4.641 aziende (+20%), che occupano 117.607 dipendenti. Si tratta di un tessuto industriale molto eterogeneo, altamente innovativo e specializzato, dove le piccole aziende convivono con i grandi gruppi. Sono 2.749 le imprese di produzione che, insieme alle 1.531 di distribuzione e alle 361 di servizi producono o distribuiscono i dispositivi medici nel nostro Paese. Il tessuto imprenditoriale del settore è caratterizzato da una forte prevalenza di PMI (quasi il 94% del totale)”.
Quella dei device medici software rappresenta una sottocategoria o una nicchia, che tuttavia sta conoscendo una forte accelerazione, impressa soprattutto dalla pandemia da Covid-19. Una ricerca condotta dalla americana Insight Partners ha stimato un valore di mercato europeo di 5.500 Mio di $ al 2019 e una crescita fino a 24.000 Mio entro il 2027.
MDR e il rischio di Responsabilità Civile Prodotti
Sul sito del Registro europeo EUMED, creato per attuare il Regolamento, si sono registrati ad oggi (febbraio 2025) 96 device medici software prodotti, importati o distribuiti da 38 aziende italiane diverse. Tutti sono segnalati in classe di rischio I (la più bassa).
E’ chiaro che si tratta, per ora, di una piccola parte di tutti i produttori di SW device medici che operano in Italia. E tuttavia quella piccola parte ha il diritto e dovere, nonché l’obbligo di legge, come vedremo, di dotarsi di una riserva finanziaria adeguata ovvero, ragionevolmente, di una polizza assicurativa rispondente al suo profilo di rischio e alle potenziali richieste di risarcimento danni provenienti dai pazienti o dalle strutture sanitarie.
Se avrete la pazienza di seguirci, scoprirete, come abbiamo voluto fare noi in Margas, quanto sia o non sia stringente il Regolamento Europeo sul fronte assicurativo, quanto sia sentito questo bisogno e se il mercato assicurativo sta tenendo o meno il passo per dare risposte adeguate nel merito e nelle possibilità di un mercato guidato dalle major, ma fatto dalle PMI, come è tipicamente in Europa e in Italia.


